和铂医药-B(02142.HK):国内首个抗FcRn临床试验数据公布,积极结果凸显研发实力
 |
 |
这是国内首个针对FcRn靶点的临床II期试验数据。此次公布的临床结果,填补了国内长期以来在重症肌无力治疗领域缺少高质量临床研究的空白局面,也凸显了公司雄厚的研发实力。
重症肌无力:巨大未被满足的治疗需求,用药情况亟待解决
重症肌无力(MG)是一种由乙酰胆碱受体(AChR)抗体介导、细胞免疫依赖、补体参与,累及神经肌肉接头突触后膜,引起神经肌肉接头传递障碍,出现骨骼肌收缩无力的获得性自身免疫性疾病。
体内致病性的IgG与神经肌肉接头的突触结合,进而抑制神经与肌肉之间的正常通信能力,导致肌无力的情况并持续加剧,可能仅局限于眼部肌肉,亦可能影响全身,包括呼吸相关肌肉并继而导致生命危险。
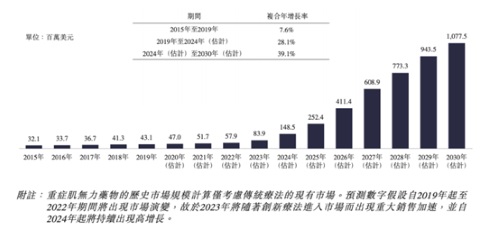
根据Frost&Sullivan数据统计显示,中国 MG 的年度发病数量约为2.94万,2015年至2019年,成年人MG的患病数由 15.71万增至 16.56 万。预计2024 年中国MG 患病数将达到 17.59 万,预计2030 年将达 18.57万。
传统重症肌无力治疗主要包括激素、传统免疫抑制剂、胸腺切除术、静脉内免疫球蛋白(IVIg)、血浆置换术。这些治疗存在起效慢、疗效不足、价格昂贵而且获得性有限,以及长期使用导致严重不良反应等问题,因此急需安全有效的创新药物。
FcRn疗法作为新一代自身免疫性疾病抗体疗法,在全球范围内受到广泛关注,并有多家国际知名生物制药公司积极布局。巴托利单抗在国内首先开展在抗FcRn疗法上的临床开发,填补了这一疗法在中国人群疗效验证的空白, 同时填补了国内长期以来在重症肌无力治疗领域缺少高质量临床研究的空白局面。
巴托利单抗:中国首个进入临床阶段的FcRn抑制剂
FcRn在防止免疫球蛋白(IgG)抗体降解中起关键作用, 而高水平的致病性IgG抗体可引发多种自身免疫性疾病。公司候选产品巴托利单抗主要作用机制为通过阻断FcRn IgG抗体的循环而达到加速降低IgG的目的。研究表明,抗FcRn疗法有望治疗60-70种由高水平致病性IgG引起的自身免疫性疾病。
相比较于传统疗法,和铂医药选择了FcRn为治疗靶点,加速体内致病性自身抗体清除,对症下药。去除这些阻碍信号传递的自身抗体是治疗重症肌无力的最有效途径,通过选择调控体内抗体代谢,来实现快速降低自身抗体的治疗目的。巴托利单抗治疗显示出更安全和更加高效的结果。
作为公司的核心候选产品,巴托利单抗是一款全人源单克隆抗体,可选择性结合并抑制新生儿晶体片段受体(FcRn)。相较于人源化的FcRn抗体,全人源抗体在亲和力和免疫原性风险上具有优势。同时,该产品采用皮下注射的方式,相较于研发中的其他FcRn抗体的静脉内注射疗法,使用更方便,患者的依从性更高,安全性更好。可以说,巴托利单抗是一款超前的并经过精心设计的自身免疫性疾病疗法产品,不论是与传统疗法相比,还是在FcRn疗法领域当中,巴托利单抗都具有相当大的竞争优势,具有成为同类最佳疗法(Best-in-Class)的潜力。
更加值得关注的是,巴托利单抗是中国首个进入临床阶段的FcRn抑制剂。从公布的数据来看,巴托利单抗在MG治疗领域获得了非常乐观和令人振奋的临床研究数据,有望填补中国MG长期未满足的治疗需求。
该项多中心、随机、双盲、安慰剂对照试验入组了30名中至重度gMG受试者,分别接受巴托利单抗340 mg (10人)或680 mg (11人)或安慰剂(9人)。给药周期为每周一次,持续6周(双盲治疗期),之后每隔一周接受340 mg,持续6周(开放标签治疗期)。
主要疗效终点是重症肌无力日常生活 (MG-ADL) 量表相对于基线的改善。次要疗效终点包括重症肌无力定量评分(QMG)、重症肌无力综合量表 (MGC) 和重症肌无力生活质量量表 (MG-QoL15) 相对于基线的改善。其他终点包括安全性和耐受性、药代动力学 (PK) 和药效动力学 (PD) 。
与海外同类产品的临床试验数据相比,巴托利单抗在重症肌无力相关疗效指标评分中亦展现出不俗实力,与海外同类主流疗法结果具有一致性,且部分数据结果上表现优异。
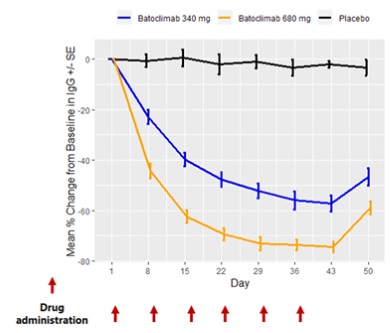
— 主要研究终点分析显示,与安慰剂相比,巴托利单抗治疗迅速起效,同时在用药后第43天(最后一剂巴托利单抗后一周),重症肌无力日常生活(MG-ADL)量表分值较基线显著降低,显示出临床和统计学意义的改善(p=0.043);
— 与安慰剂组对比,巴托利单抗在临床疗效的四项评估MG-ADL、QMG、MGC和 MG-QoL15,均显示出起效快、显著和持续的临床改善;
— 巴托利单抗组中57%和76%的受试者表现出持续的临床改善(连续6周,MG-ADL评分降低≥2分,QMG评分降低≥3分),而安慰剂组仅有33%和11%的受试者获得MG-ADL和QMG方面的改善;
— 所有巴托利单抗组受试者均表现出显著的IgG水平下降(在第43天,340 mg、680 mg治疗组受试者的IgG水平较基线分别下降57%和74%),并与临床获益密切相关。
巴托利单抗治疗总体上具有良好的安全性和耐受性,不良事件发生率与安慰剂组相当,大多数不良事件为轻度,且未发生严重不良事件及导致停药的不良事件。
巴托利单抗获得国家药品监督管理局药品审评中心(CDE)授予突破性治疗药物资格,这也是国内首款自身免疫性疾病产品获国家突破性疗法认定。目前,巴托利单抗已经获得CDE认可进入临床III期研究,2021下半年启动。
小结
此次和铂医药的核心产品巴托利单抗公布的关于用于治疗重度肌无力的临床II期关键性数据令人振奋,也是继获得国家药监局“突破性治疗”资格认定后又一重大利好消息。
从资本市场角度来看,对于创新药企而言,每一次核心产品的重大里程碑事件都有望成为资本市场的催化剂,并伴随着商业化进程的不断推进之下逐步兑现。
长远来看,中国自身免疫性疾病领域,非常需要有效药物能够为患者提供帮助与治疗。根据Frost&Sullivan数据显示,仅中国2030年自身免疫性疾病就将达到229亿美元市场规模。核心重磅资产在未来将会陆续开花结果,为患者带来创新疗法,值得关注与期待。
Copyright 2021 亚太商讯. All rights reserved. (via SEAPRWire)